La FDA concede a Suzhou CH Biomedical la aprobación para comenzar los ensayos clínicos del sistema de asistencia ventricular izquierda BrioVAD™, prometiendo soluciones innovadoras para la insuficiencia cardíaca.


Recientemente, Suzhou CH Biomedical, Inc. anunció que su sistema de asistencia ventricular izquierda de próxima generación completamente levitado magnéticamente, BrioVAD™, ha recibido la aprobación de la FDA de EE.UU. para realizar ensayos clínicos. El ensayo clínico, denominado INNOVATE, ha obtenido la Exención de Dispositivo en Investigación (IDE) de la FDA, permitiendo el inicio condicional del reclutamiento de pacientes.
Este estudio evaluará la eficacia y seguridad de BrioVAD™, un nuevo sistema de asistencia ventricular izquierda completamente levitado magnéticamente desarrollado por CH Biomedical, en el tratamiento de la insuficiencia cardíaca refractaria. Mientras tanto, CH Biomedical ha convocado la primera reunión de investigadores para el estudio e iniciado el trabajo relacionado para los centros de ensayos clínicos en los Estados Unidos.

▲ CH Biomedical Celebra la Primera Reunión de Investigadores para el Ensayo Clínico INNOVATE
El sistema de asistencia ventricular izquierda BrioVAD™, aprobado por la FDA en los Estados Unidos, se basa en la excelente compatibilidad sanguínea del producto existente, CH-VAD. A través de varias innovaciones tecnológicas, logra la portabilidad de los componentes externos mientras mejora aún más el rendimiento general del sistema. Además, el estudio INNOVATE empleará un diseño controlado aleatorio para comparar y evaluar BrioVAD™ con productos previamente aprobados por la FDA.
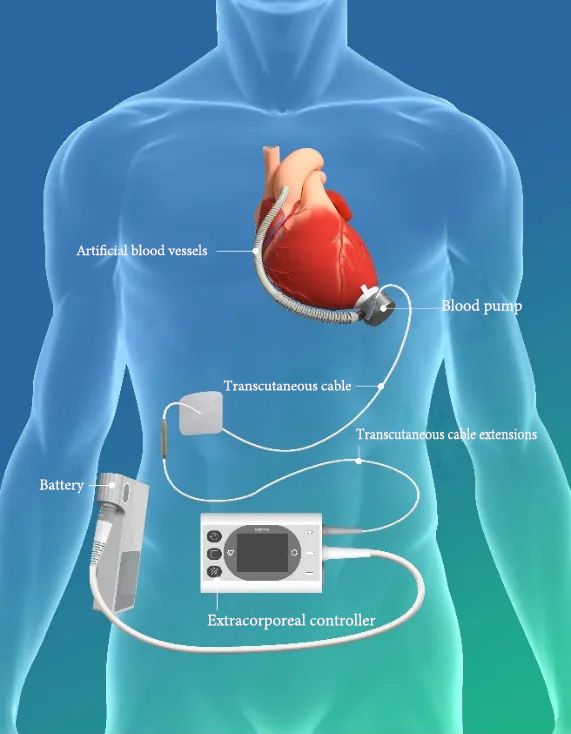
▲ Esquema del Producto del Sistema de Asistencia Ventricular Izquierda BrioVAD™
CH-VAD es el primer dispositivo de asistencia ventricular izquierda implantable completamente levitado magnéticamente desarrollado en China. Desarrollado conjuntamente por el equipo del Hospital Fuwai y CH Biomedical, pesa 186 g, con un diámetro de bomba sanguínea de 50 mm, un grosor de 26 mm y una tasa de flujo máxima de 10 L/min. La tecnología central de este producto involucra principalmente la tecnología de bomba sanguínea completamente levitada magnéticamente, que ha obtenido múltiples patentes en China y los Estados Unidos, convirtiéndolo en un dispositivo médico pionero en el país. En comparación con productos internacionales similares, sus indicadores clave de rendimiento han alcanzado el mismo nivel, con un tamaño de bomba más pequeño y una mejor invasividad de implante.
CH-VAD ha estado clínicamente disponible desde 2018 y recibió la aprobación de la NMPA para su uso con vasos sanguíneos artificiales específicos en 2021, proporcionando soporte mecánico para la circulación sanguínea de pacientes con insuficiencia cardíaca refractaria en etapa terminal, utilizado como terapia transitoria antes del trasplante de corazón o para recuperar la función cardíaca.

▲ Sistema de Asistencia Ventricular Izquierda Implantable CH® (CH-VAD)
CH-VAD consta de componentes internos implantables, componentes externos de transporte, componentes periféricos y herramientas quirúrgicas especializadas. Es un dispositivo electromecánico integrado utilizado para reemplazar parcialmente la función de bombeo del corazón y mantener la circulación sanguínea humana. Su componente central es una bomba de sangre que extrae sangre del corazón, aumenta su presión y la entrega a la aorta, descargando la carga de trabajo del corazón natural, permitiéndole descansar, mientras también complementa la capacidad de bombeo insuficiente del corazón natural.
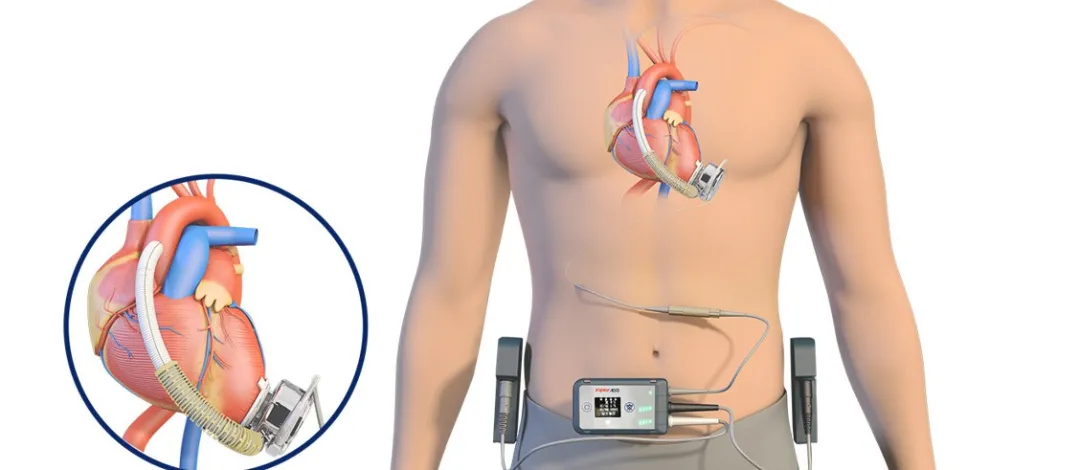
▲ Sistema de Asistencia Ventricular Izquierda Implantable CH® (CH-VAD)
Desde su lanzamiento, CH-VAD ha sido utilizado en más de 180 pacientes en más de 40 hospitales cardíacos de primer nivel en todo el país. El primer paciente ha sobrevivido durante más de 6 años y continúa llevando una vida de alta calidad. CH-VAD cuenta con un sistema de derechos de propiedad intelectual independiente completo construido desde cero y ha obtenido protección de patente en China, Estados Unidos, Europa, Japón y otras regiones.
En abril de 2024, en el simposio "Spin Doctors and Heart Hotties: Unleashing the Future of MCS Devices" de la ISHLT, el Profesor Xianqiang Wang del Hospital Fuwai, Academia China de Ciencias Médicas, presentó los resultados del seguimiento a largo plazo de CH-VAD en el escenario internacional. En este estudio retrospectivo y observacional de un solo centro, los pacientes con insuficiencia cardíaca en etapa terminal tratados con CH-VAD mostraron altas tasas de supervivencia y bajas tasas de complicaciones, sin casos de trombosis de bomba, accidentes cerebrovasculares discapacitantes o fallos importantes del dispositivo.
Objetivos de la Investigación
Para evaluar aún más la eficacia y seguridad a largo plazo de CH-VAD, el Hospital Fuwai llevó a cabo este estudio retrospectivo y observacional de un solo centro, que incluye pacientes con insuficiencia cardíaca tratados con CH-VAD desde junio de 2017 hasta agosto de 2023, para analizar estadísticamente sus datos clínicos y pronóstico a largo plazo.
Métodos de Investigación
Este estudio incluyó a 50 pacientes con duraciones de seguimiento que varían de 3 meses a 6.7 años. La duración promedio del soporte de la bomba para los pacientes fue de 2.4 años, y los 50 pacientes se sometieron con éxito a la implantación de LVAD. La operación de la bomba de sangre de los pacientes fue estable tanto intraoperatoriamente como postoperatoriamente, y la hemodinámica volvió a la normalidad.
Resultados de la Investigación
Utilizando el análisis de supervivencia de Kaplan-Meier, las tasas de supervivencia a 1 año, 2 años y 3 años de los pacientes fueron del 93%, 93% y 89%, respectivamente, todas superiores a las de estudios clínicos internacionales y en entornos del mundo real. Entre los 50 pacientes, solo 2 se sometieron a un trasplante de corazón como puente. Tres pacientes recuperaron completamente su función cardíaca y se les retiró el LVAD.
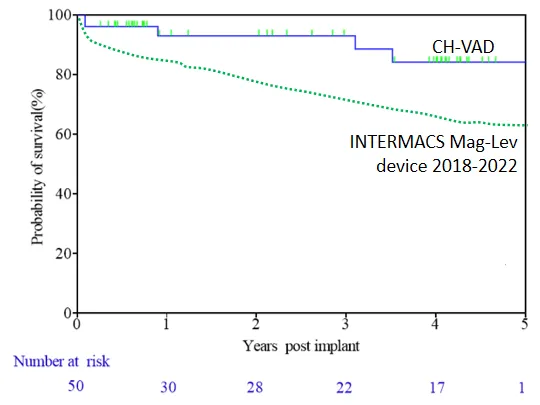
▲ Supervivencia de pacientes durante el seguimiento
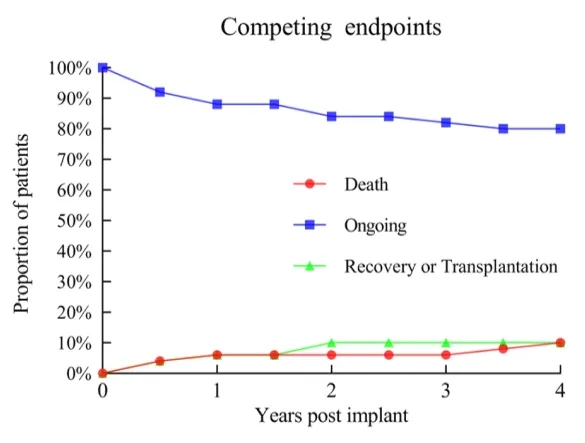
▲ Incidencia de eventos para diferentes puntos finales
En este estudio, la tasa general de incidencia de eventos adversos fue baja. La excelente compatibilidad sanguínea de CH-VAD se reflejó, sin observarse casos de trombosis de bomba, hemólisis o eventos de accidente cerebrovascular discapacitante.
Entre todos los pacientes, solo 2 experimentaron accidentes cerebrovasculares isquémicos (0.02 por año-persona) y 1 experimentó un accidente cerebrovascular hemorrágico (0.01 por año-persona), con la recuperación de las funciones neurológicas de todos los pacientes durante el seguimiento. El evento adverso más común fue la infección postoperatoria, que se previno y controló eficazmente con la acumulación de experiencia en manejo interdisciplinario, llevando a un buen pronóstico para la gran mayoría de los pacientes. No hubo fallos importantes del dispositivo ni cirugías de reemplazo de bomba durante el período de seguimiento, indicando una alta fiabilidad a largo plazo del dispositivo.
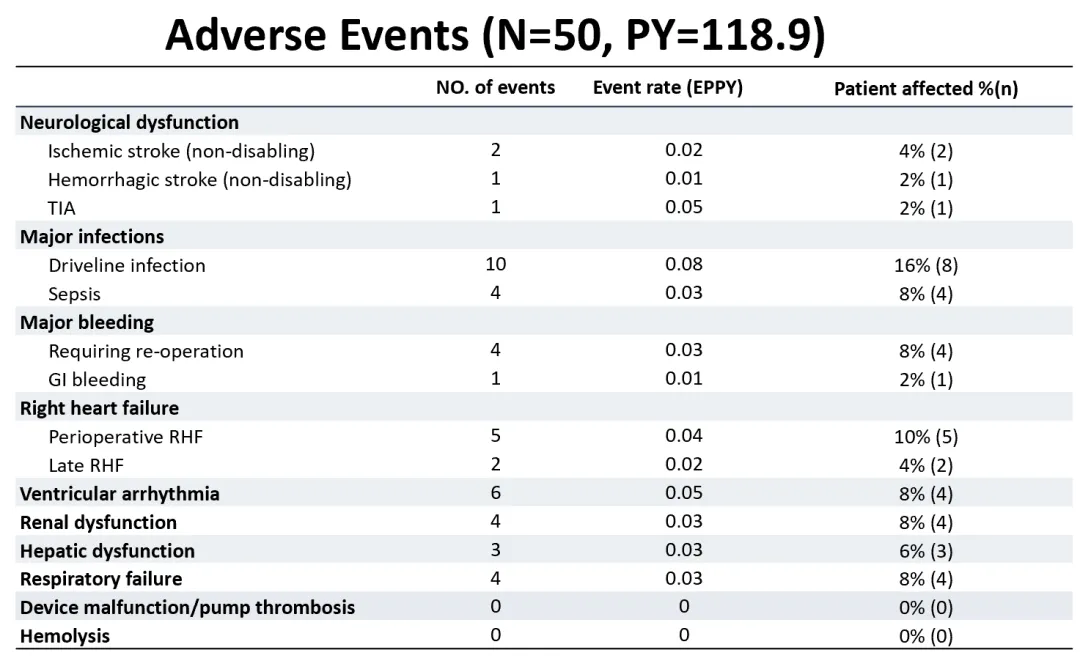
▲ Incidencia de diversos tipos de eventos adversos
El 15 de abril de 2024, la Administración de Alimentos y Medicamentos de EE.UU. (FDA) anunció un retiro de los sistemas de asistencia ventricular izquierda implantables HeartMate II y HeartMate 3 de Abbott/Thoratec debido a la ocurrencia de Obstrucción de Injerto de Flujo Extrínseco (EOGO) causada por fuerzas externas. Este retiro afectó a 13,883 dispositivos, representando el 56% de los productos del mercado, con una tasa de ocurrencia estimada de Kaplan-Meier de 0.24% a 2 años y 2.06% a 5 años para EOGO de HeartMate 3.
Los incidentes de EOGO relacionados con HeartMate II y HeartMate 3 en este retiro no son nuevos para la industria. Hasta ahora, la FDA ha recibido numerosos informes de eventos adversos relacionados con EOGO con HeartMate, sumando 273 eventos de lesiones y 14 eventos de fallecimiento.
Es importante señalar: Primero, un retiro de Clase I por parte de la FDA para dispositivos médicos no significa la cesación de la producción o el uso del producto, sino que se toman medidas correctivas para los problemas identificados, y los dispositivos seguirán utilizándose en entornos clínicos. En segundo lugar, la razón del retiro de Clase I de HeartMate II y HeartMate 3 por parte de la FDA es EOGO, que es causado por la funda de refuerzo de material PTFE denso de HeartMate II y HeartMate 3, resultando en la acumulación de biomaterial no celular exudado, obligando al vaso sanguíneo artificial a comprimirse hacia adentro. Sin embargo, los dispositivos LVAD domésticos representados por CH-VAD han resuelto los defectos de diseño anteriores de HeartMate mediante el diseño hueco de la funda de refuerzo.
La tecnología de levitación magnética permite una rotación estable sin necesidad de condiciones líquidas, reduciendo significativamente el daño sanguíneo y, por lo tanto, reduciendo la ocurrencia de complicaciones relacionadas como trombosis y accidente cerebrovascular. CH-VAD logra una suspensión estable en cinco grados de libertad en los ejes X, Y y Z al organizar el estator del motor y el estator de levitación magnética en los lados interno y externo del rotor, asegurando una buena resistencia a los golpes y una operación estable a largo plazo, reduciendo el daño sanguíneo. Simultáneamente, el diseño optimizado del canal de flujo asegura un flujo sanguíneo suave desde el tubo de entrada hasta la posición del impulsor a través de un cono nasal, con un canal de flujo secundario en forma de U con un espacio de 250 μm, asegurando tanto un flujo sanguíneo suave como un buen efecto de enjuague.
El Profesor Zengsheng Chen de la Universidad Beihang enfatizó que el "culpable" de este retiro radica en la funda de refuerzo de material PTFE denso de HeartMate II y HeartMate 3, mientras que los dispositivos LVAD domésticos representados por CH-VAD han resuelto el problema del aplastamiento del vaso artificial mediante el diseño hueco de la funda de refuerzo.
Los VAD actuales son bombas implantables de vanguardia. Tomemos el CH-VAD como ejemplo. Está equipado con un notable impulsor, una sola parte móvil que propulsa la sangre de manera eficiente en una sola dirección. Suspendido por imanes, este impulsor funciona sin fricción y no tiene componentes propensos al desgaste.
Los impulsores juegan un papel crucial en los VAD. Cuando pasa corriente a través de los imanes, el impulsor comienza a girar. La sangre es aspirada hacia el centro del impulsor bajo presión negativa, y sus aspas giratorias aceleran rápidamente la sangre desde el centro hacia los bordes exteriores. Esta sangre transformada, ahora bajo presión positiva, fluye fuera de la bomba a través de la boquilla de descarga hacia el cánula de salida.
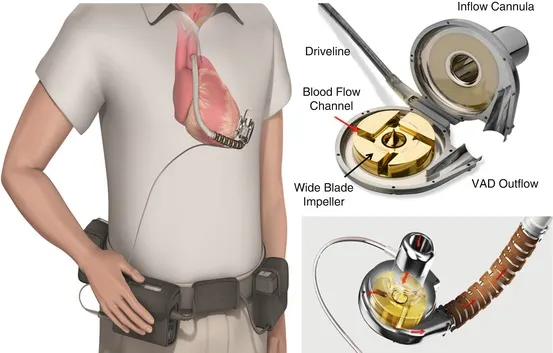
▲ El impulsor de la bomba de sangre en el VAD
El diseño del impulsor es primordial. Sujetado por imanes y rodamientos especializados, gira suavemente sin tocar los lados. Este diseño no solo minimiza el daño sino que también asegura la longevidad del dispositivo.
En Manners Technology, nos especializamos en la fabricación de piezas para dispositivos médicos, incluidos los impulsores para VAD. Nuestro compromiso con la calidad está respaldado por nuestras certificaciones, incluidas ISO 9001:2015 e ISO 13485.
También estamos colaborando con una empresa alemana líder para desarrollar impulsores aún más eficientes y confiables para los VAD. Juntos, nos esforzamos por producir piezas que superen las expectativas. Ya sea que necesite piezas especializadas o asistencia con diseños, nuestros servicios personalizados están diseñados para satisfacer sus necesidades.